
①金属钨作电极是利用了金属钨的导电性和;用氩气作保护气,是因为氩气的化学性质。
②如果在没有保护气的情况下焊接金属,可能导致焊接不牢,原因是。

A.①③②④⑤⑥
B.③②①④⑤⑥
C.③①②⑤④⑥
D.②③①⑤④⑥
①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是。
②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是。
③海水制镁。实际生产中,步骤Ⅲ常选用作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是。
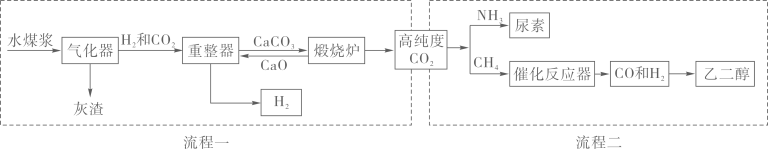
气化器中发生的主要反应为:Ⅰ.H2O+C=CO+H2;Ⅱ.CO+H2O=CO2+H2 , 其中属于置换反应的是(填“Ⅰ”或“Ⅱ”),反应Ⅱ中发生还原反应的物质是、。
在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水,该反应的化学方程式为。尿素属于化肥中的肥,能使作物枝叶繁茂。
(查阅资料)过氧化钠与水反应生成氢氧化钠和氧气。
(设计实验)小组同学利用如图装置进行实(忽略稀盐酸的挥发)。

|
步骤 |
实验操作 |
实验现象 |
实验结论 |
|
① |
将带火星的木条伸入装置E中 |
|
产物中有氧气 |
|
② |
反应后取装置C中少量固体于试管中,加水完全溶解 |
|
固体中有未反应的过氧化钠 |
|
③ |
向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中 |
|
产物中有碳酸钠 |
(查阅资料)①无水氯化钙固体可做干燥剂;②有机物中的氯元素燃烧后通常转化为氯化氢。
(设计实验)兴趣小组设计并进行了如图所示的实验。(装置气密性良好)

实验过程中,在装置C中观察到现象,证明该塑料样品中含有氯元素,该反应的化学方程式是。
(记录数据)6.25g样品在A装置中充分燃烧,反应产物被完全吸收后,测得相关实验数据如表。
| 装置 | B | C | D | E |
| 反应后装置增加的质量/g | 1.80 | 3.65 | 0.09 | 8.80 |
(分析与结论)根据以上数据分析与计算,6.25g样品中氢元素的质量为g,该塑料样品的组成元素是。
(反思评价)电炉加热前要先通一会儿氧气,目的是。


①根据上述实验分析推断,图一中试管②完全反应后所得的溶液中一定含有的溶质是。
②小组同学把沉淀M、N混合后置于烧杯丙中,向其中加入过量的稀盐酸,观察到的实验现象是。把烧杯丙中反应后的混合物与滤液C全部倒入废液缸中,反应结束后废液缸内上层溶液中,除酚酞外一定还含有的溶质是。
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
①如图图象中a的数值是。

②求该实验中所用稀硫酸的溶质质量分数。(写出计算过程)