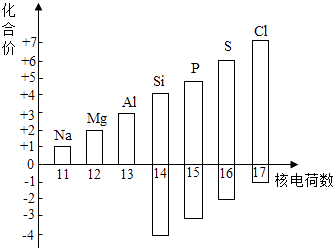
①从图中可以看出,氯元素的最高正价是.
②若某元素既可显正价,又可显负价,则最高正价与最低负价绝对值的代数和为.
③写出图中元素的化合价随着核电荷数递增的一条变化规律:.
①某金属原子的结构示意图为 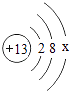 ,则最外层电子数x=;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为.
,则最外层电子数x=;若最外层电子失去,达到相对稳定结构,该带电粒子的符号为.
②我国古代发明了“曾青(即硫酸铜)得铁化为铜”的湿法炼铜法,请用化学方程式表示反应原理:;该反应中,更易失去电子的金属是.

①富氧燃烧与普通燃烧相比,能提供更多的O2 , 使锅炉中的CO充分燃烧,请写出CO燃烧的化学方程式:;
②采用该技术有利于对CO2捕捉、封存和利用,减少碳排放,获得的CO2可用于制干冰,干冰的用途之一是,捕捉CO2也可用NaOH溶液,请写出对应的化学方程式:;
③采用图中工艺,可以使煤燃烧产生的氮氧化物和气体的排放总量大大下降,从而有效防止酸雨的形成.
【实验操作】
向试管中加入5粒石灰石,倾倒约试管体积 的稀盐酸(1:1);观察不到气泡中,仍有固体剩余;将试管静置.
【实验探究Ⅰ】
甲同学通过实验排除了CaCl2的可能性,简述其实验方案:.
乙同学将CO2通入蒸馏水中至饱和,测得pH>5.
综合甲、乙两同学实验,得出的结论是:剩余液中还含有.
【实验探究Ⅱ】小组同学向试管中继续加入稀盐酸(1:1),又有大量气泡产生.
①由此得出的结论是;写出反应的化学方程式:.
②比较稀盐酸加入前后的实验现象,解释“又有大量气泡产生”的原因:.
①反应剩余液放置一段时间后,溶液pH增大,其主要原因是.
②假如用100g14.6%的稀盐酸和足量的石灰石反应,看不到气泡产生时,停止收集气体,收集到的CO2质量(填“>”、“<”或“=”)8.8g.
C6H12O6═2C2H5OH+2CO2(反应条件省略,下同)
①求2.7kg上述糖理论上制乙醇的质量.(请将计算过程写出)
②糖类和乙醇在空气中燃烧的化学方程式分别为:
C6H12O6+6O2═6CO+6H2O
C2H5OH+3O2═2CO2+2H2O
已知完全燃烧2.7kg上述糖生成1.62kg的水,若将①中制得的乙醇完全燃烧,则生成水的质量为.