


① Fe→FeCl2→Fe(OH)2→Fe(OH)3
② Na→Na2O→Na2CO3→NaHCO3→NaOH
③ Mg→MgCl2→Mg(OH)2
④ Al→Al2O3→Al(OH)3
⑤ Al→NaAlO2→Na2CO3


 B .
B . 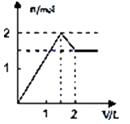 C .
C .  D .
D . 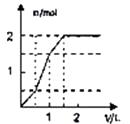

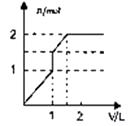
溶液 | 加入物质 | 对应的图象 |
⑴饱和石灰水 | 通过量CO2气体 | |
⑵氯化铝溶液 | 加入过量氨水 | |
⑶MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | |
⑷含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
①当 Na 与 Al 的物质的量之比为时,混合物与水产生的 H2 最多。
②当 Na 与 Al 的物质的量之比为时,混合物与水反应产生的 H2 的体积为 13.44 L(标准状况下)。

请回答下列问题:

①B是,D是,(均用化学式表示)
②写出上述反应中由A生成C的化学方程式:。

请回答:
①化合物甲所含元素为(填写元素符号),甲的化学式为。
②气体B与水反应的离子方程式为。
③甲与水反应的化学方程式为。