物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9] | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
选项 | 实验内容 | 结论 |
A | 向某溶液中加入盐酸产生能使澄清石灰水变浑浊 的气体 | 该溶液中一定含有 CO32-或SO32- |
B | 向某溶液中加入少量的盐酸,生成白色沉淀 | 溶液中不一定含有 Ag+ |
C | 将某有机物与 NaOH、乙醇混合共热后加入 AgNO3 溶液,没有出现白色沉淀 | 该有机物中不含氯原子 |
D | 将液溴、苯、FeBr3 混合于烧瓶中反应,将产生的 气体导出至 AgNO3 溶液中,生成了淡黄色沉淀 | 液溴与苯的反应属于取代反应, 而不是加成反应 |

物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) | 溶解性 |
乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和酒精 |
丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.萃取 B.蒸发 C.结晶 D.过滤 E.蒸馏 F.分液
①取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
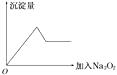
②另取部分溶液加入Na2O2 , 有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
试问:Cu2+、NH ![]() 、Al3+、Mg2+、Na+、Fe3+、CO
、Al3+、Mg2+、Na+、Fe3+、CO ![]() 、K+、SO
、K+、SO ![]() 等离子中一定存在的离子是;可能存在的离子是;一定不存在的离子是。
等离子中一定存在的离子是;可能存在的离子是;一定不存在的离子是。
实验步骤和方法 | 实验现象 |
Ⅰ.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
Ⅱ.各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
Ⅲ.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
Ⅳ.各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
试给它们的试剂瓶重新贴上标签:
A,B,C,D,E,F,G.
①采用装置c进行冷凝回流,回流的主要物质有__________。
②利用温度计控制温度,适宜的温度范围为(填序号)__________。
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。
此操作所需要的玻璃仪器除烧杯外,还需,用NaOH溶液洗涤的作用是;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
A.重结晶
B.过滤
C.蒸馏
D.萃取
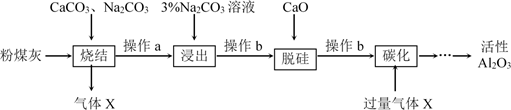
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
| 金属离子 | ||||
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、、(填仪器名称)。
②下列操作会使所配溶液浓度偏低的是。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
①滴定过程中反应的离子方程式为。
②量取KMnO4样品溶液应选用(填“酸式”或“碱式”)滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,则最终的测定结果将(填“偏大”、“偏小”或“不变”)。
③现取KMnO4粗品10g,配成100mL溶液,取25.0 mL用(4)中配制的草酸溶液滴定,并进行3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,请问KMnO4粗品的质量分数为。(已知:KMnO4的摩尔质量为158g/mol)