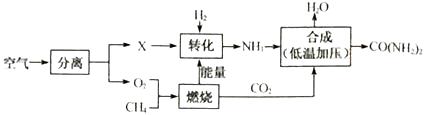
②点燃CH4之前应。 8g CH4完全燃烧消耗32gO2 , 生成agCO2和18gH2O,则a=。
③由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有变化(填“能量”或“原子个数”)。
I.大米、番茄和牛奶是生活中常见的食品,每100g食品中营养成分的含量如下表:
蛋白质/g | 脂肪/g | 糖类/g | 矿物质/mg | 维生素C/mg | |||
钙 | 磷 | 铁 | |||||
大米 | 6.7 | 0.9 | 78 | 7 | 136 | — | 0.05 |
番茄 | 0.6 | 0.3 | 2 | 8 | 37 | 0.4 | 11 |
牛奶 | 3.1 | 3.5 | 6 | 120 | 90 | 0.1 | 1 |
A.原子 B.单质 C.元素
A.糖类 B.油脂 C.蛋白质
A.密度大 B.耐腐蚀 C.硬度大
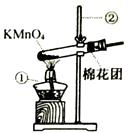
写出右图中有标号仪器的名称:①,②。
[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据分析:
由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是。
铁丝在纯净氧气中燃烧的化学反应方程式为 。
6ZnFe2O4 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
3ZnFe2O4+H2↑
ZnFe2O4中Fe的化合价为。
熔炼制备Mg2Cu合金时,通入氩气的目的是。
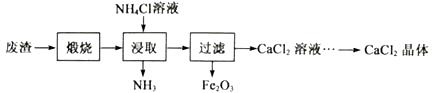
已知:NH4Cl溶液显酸性,且浓度越高酸性越强
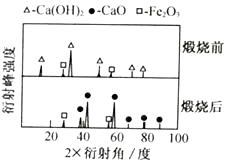
96测定晶体(CaCl2·xH2O)的组成:
a.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水.使其全部溶解。
b.再向其中加入足量的Na2CO3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值(填“偏大”、“偏小”或“ 不变”。