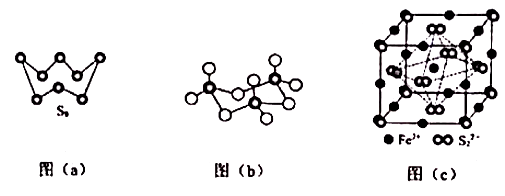
| 金属离子 | ||||
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
已知:
该催化重整反应的
。有利于提高
平衡转化率的条件是(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时
的转化率是50%,其平衡常数为
。
积碳反应 | 消碳反应 | ||
75 | 172 | ||
活化能/ | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂XY(填“优于或劣于”),理由是.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是(填标号)
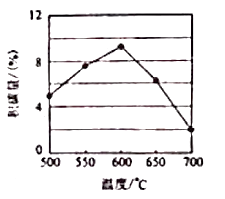
A.K积、K消均增加
B.V积减小、V消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
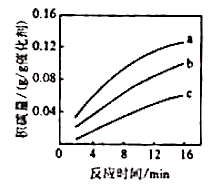
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在
一定时,不同
下积碳量随时间的变化趋势如右图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为

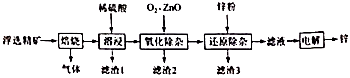
①通入氮气的目的是。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、。
③为防止倒吸,停止实验时应进行的操作是。
④样品完全分解后,装置A中的残留物含有 和
,检验
存在的方法是:。
①称量 样品于锥形瓶中,溶解后加稀
酸化,用
溶液滴定至终点。滴定终点的现象是。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
溶液滴定至终点,消耗
溶液
,该晶体中铁的质量分数的表达式为。
H2S | S | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题: