ⅰ.组装好装置,检验装置气密性,向瓷舟中加入。
ⅱ.向体系中通入干燥纯净的一段时间。
ⅲ.使通过
, 进入到硬质玻璃管中,同时打开管式炉,对反应物加热。
ⅳ.制备实验结束后,继续通入纯净的 , 直至产物冷却为室温,硬质玻璃管右端有紫色薄片出现。
ⅴ.检测产品纯度。
实验装置如图所示:

已知相关部分物质的性质如下表:
无水氯化铬( | 紫色晶体,950℃升华,易溶于水 |
绿色粉末固体,熔点2435℃,高温下能被 | |
无色液体,沸点:76~77℃ | |
光气( | 无色气体,剧毒,遇水水解: |
回答下列问题:
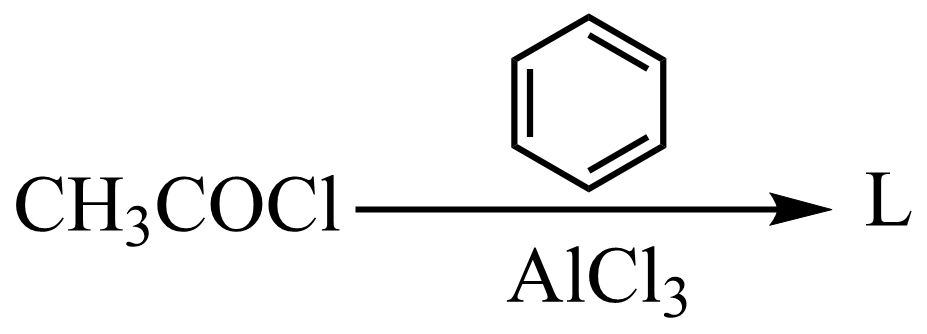
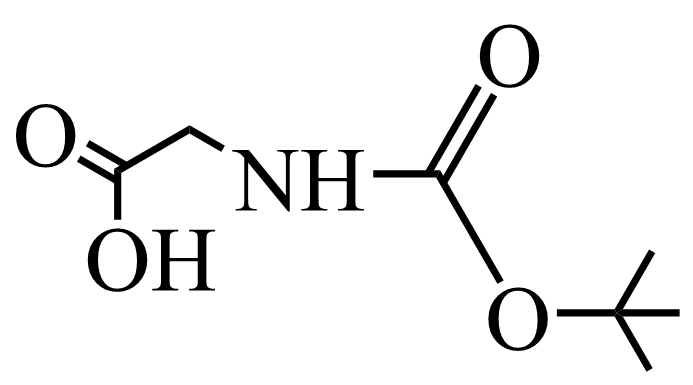
已知:![]() (“Boc—”表示
(“Boc—”表示 )
)
回答下列问题:
①能发生银镜反应
②含硝基
③含苯环结构
其中核磁共振氢谱中有2组峰的结构简式是(填一种)。
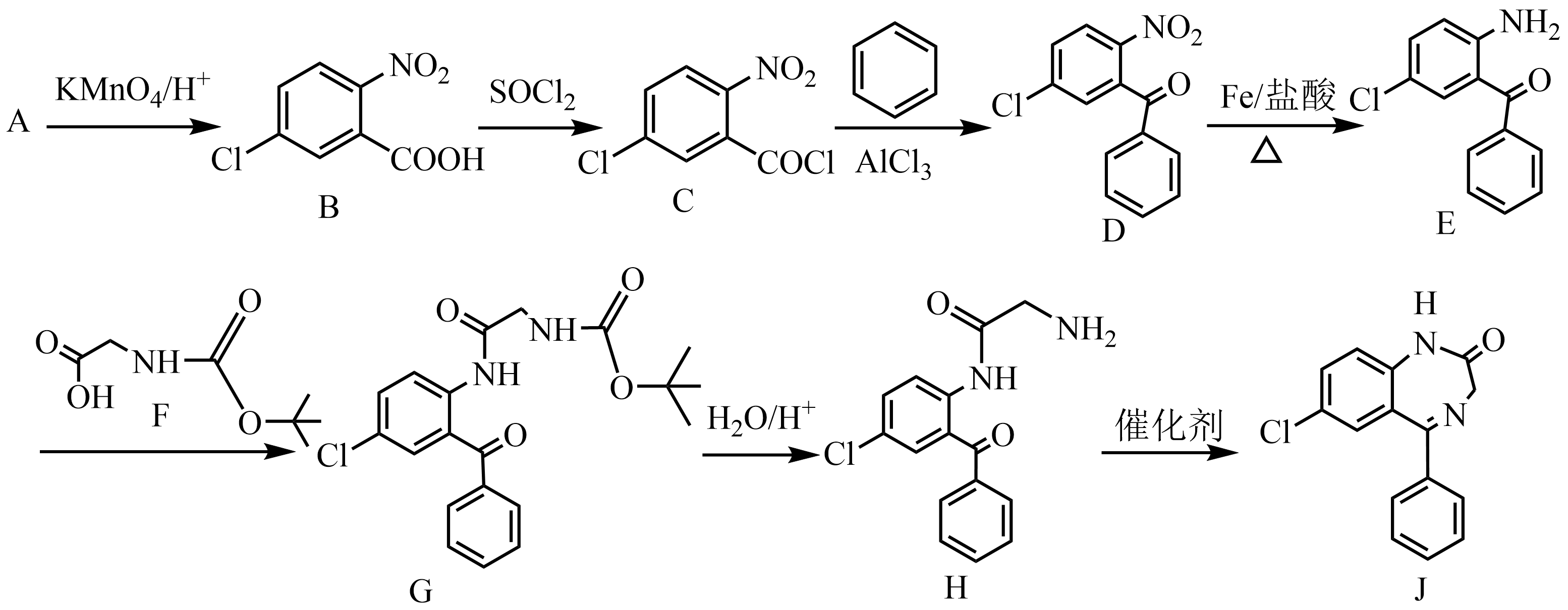
 为原料制备
为原料制备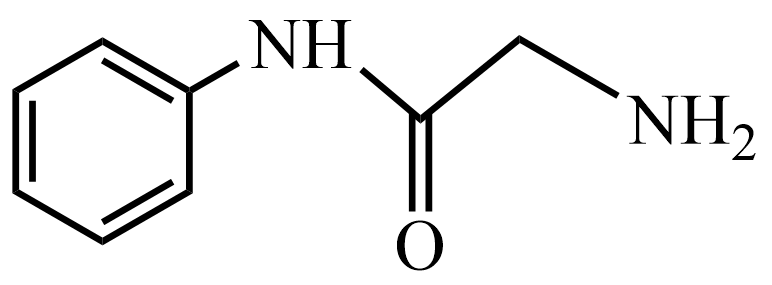 的合成路线:(其他试剂任选)。
的合成路线:(其他试剂任选)。