已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
物质 |
|
| ||||
浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值 | 171 | 1130 | 603 | 662 | 116 | -361 |
根据表中数据,回答下列问题:
甲. 乙.酸性
丙.酸性
氧化剂 | ||||
还原产物 |
请判断,等物质的量的四种氧化剂分别与足量作用,得到
最多的是。

①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为。
②在废水处理整个过程中,催化剂为,氧化剂为。
③反应Ⅲ中与
等物质的量反应,写出反应的化学方程式。
I.
II.
反应。(用
表示)
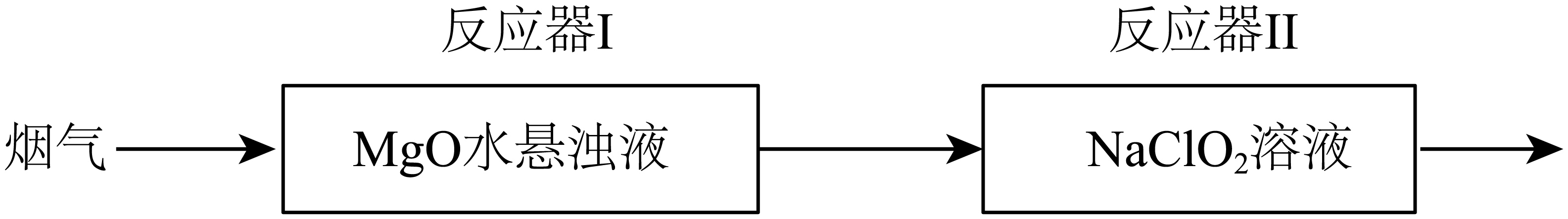
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式。
②反应器II中所发生的反应为 , 盛有
溶液最多能吸收
(标准状况下)的体积为。
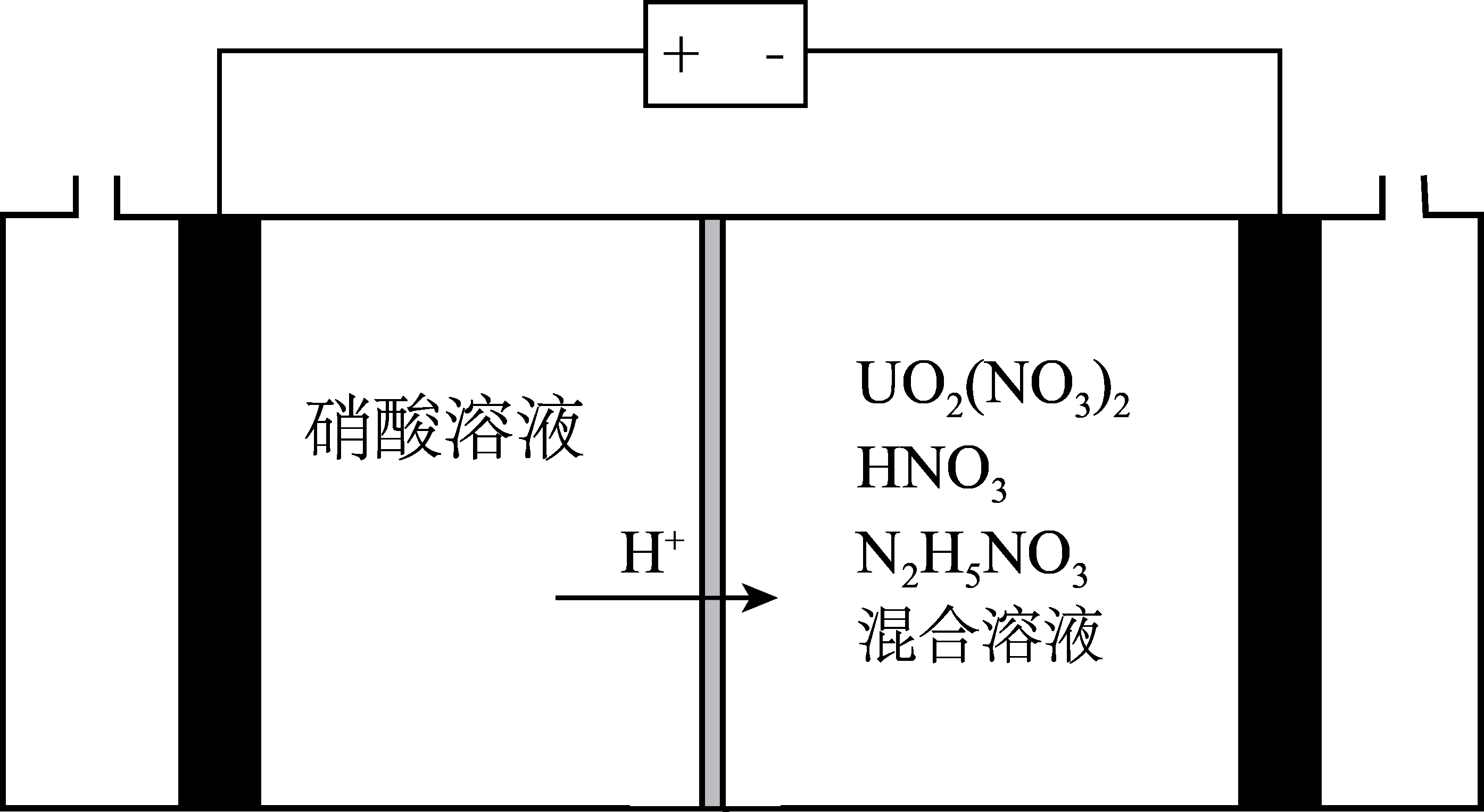
阴极发生的反应为: , 阴极区溶液中发生反应:
、
。
①阴极上发生的副反应为:。
②阴极区溶液中加入的目的是。
③电还原处理+6价的铀转移
, 阴极区
减少mol。
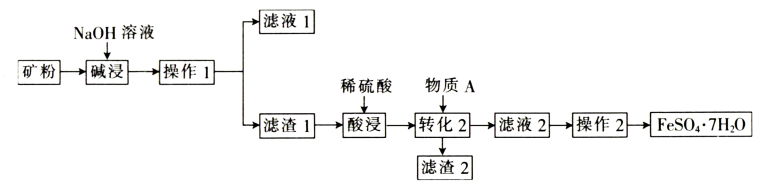
请回答下列问题:
①若配制样品溶液的过程中,容量瓶中有少量蒸馏水残留,则对所配溶液浓度的影响是(填“偏低”“偏高”或“无影响”)。
②样品的纯度约为(保留三位有效数字)。
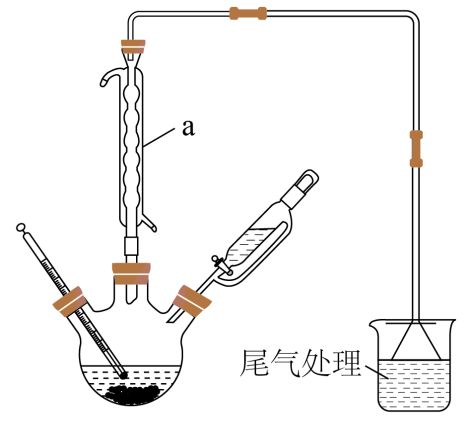
向三颈烧瓶中加入镓镁合金、碘甲烷和乙醚(用表示),加热(55℃)并搅拌
。蒸出低沸点有机物后减压蒸馏,收集
。向
中逐滴滴加三正辛胺(用
表示),室温下搅拌
, 并用真空泵不断抽出
蒸气,制得
。将
置于真空中加热,蒸出
。
已知:①常温下,为无色透明的液体,易水解,在空气中易自燃。
②相关物质的沸点信息如下表:
物质 | ||||
沸点/℃ | 55.8 | 40.3 | 34.5 | 365.8 |
回答下列问题: