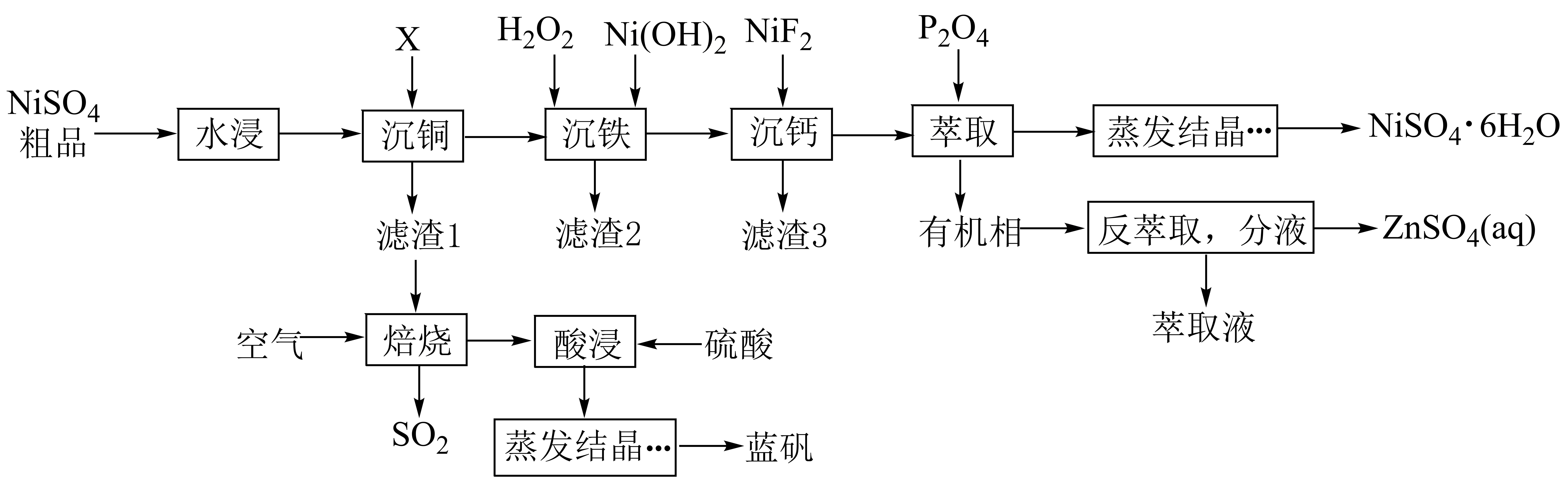
已知:常温下,①;
②部分金属离子(起始浓度为0.1 , 沉淀完全的浓度为
)生成氢氧化物沉淀的pH范围如下表:
金属离子 | ||||||
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 82 | 8.3 | 8.9 | 13.8 |
回答下列问题:
A.1.5 B.4.0 C.6.3 D.6.9
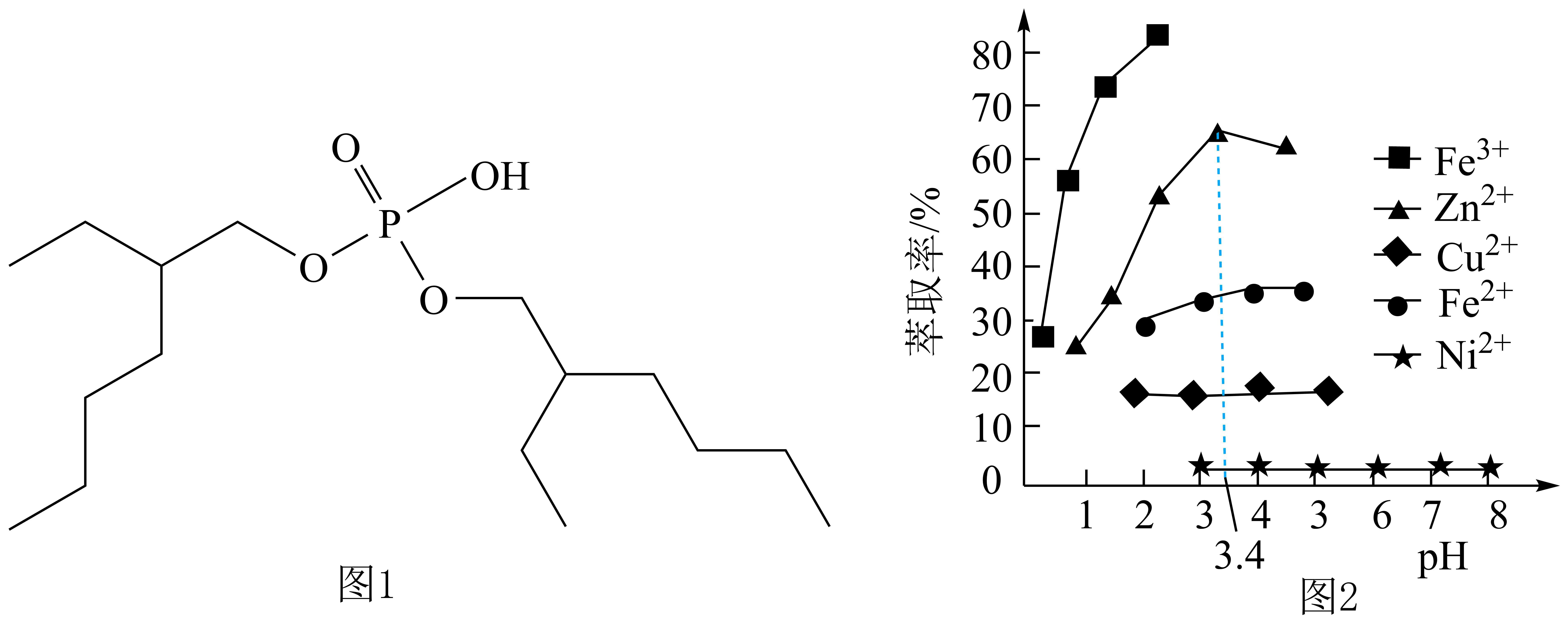
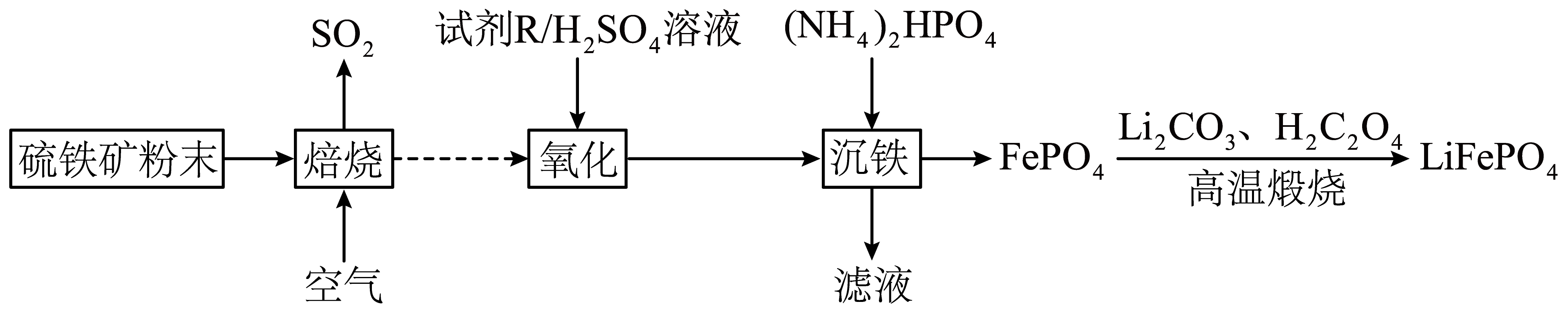
①已知室温下难溶物溶度积常数如下表,离子浓度小于10-5mol/L,认为沉淀完全。
难溶物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | FePO4 |
KSD |
② ,
,
回答下列问题:
①若“酸浸”工序用硫酸,“还原”工序加入FeS。“还原”工序的离子方程式为,滤渣的成分是(填化学式)。
②“除铝”工序可加入的难溶物质是(填化学式),除净铝离子需要调节的最小pH为(结果保留一位小数)。
A.HNO3 B.H2O2 C.Ca(ClO)2 D.KMnO4
判断是否氧化彻底的试剂名称为。