
①16.0g甲烷理论上可制备氢气的质量为 g。
②“分离“时发生反应的化学方程式为 。
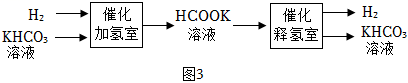
①催化加氢室发生反应的化学方程式为 。
②采用HCOOK溶液释氢优于HCOOH释氢,原因有产生H2的速率快和 。
③在氢气的贮存和释放中可循环使用的物质是 。
【猜想】白色固体为:①MgCO3;②Mg(OH)2;③xMgCO3•yMg(OH)2•zH2O。
【实验1】称取3.64g白色固体,加入过量的稀盐酸,出现气泡,则猜想 (填序号,下同)不成立。将产生的气体全部通入过量的澄清石灰水中,产生3.0g沉淀,则猜想 成立。
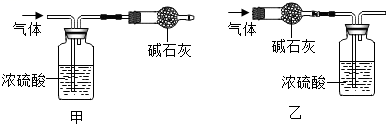
实验测得浓硫酸的质量增加1.44g,碱石灰的质量增加2.64g,则x:y:z=。