CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2 , 在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是。

电池的负极反应式:。
电池的正极反应式:6O2+6e−=6O2−
6CO2+6O2−=3C2O42−
反应过程中O2的作用是。
该电池的总反应式:。
回答下列问题:
i.CO (g) +3H2(g) CH4(g)+H2O(g) △H1= - 206 kJ·mol-1
ii.CO2(g) + 4H2(g) CH4(g) + 2H2O(g) △H2
iii.CO2(g) +H2(g) CO(g) + H2O(g) △H3= + 41 kJ ·mol-1
①△H2 =kJ·mol-1;
②采用“CO选择性甲烷化”的方法消除CO,该方法最明显的缺点是。
③欲使CO体积分数必须低于10 ×10-4% ,应采取的措施是(填标号)。
A.升高温度 B.降低压强 C.使用CO加氢催化剂 D.使用CO2加氢抑制剂
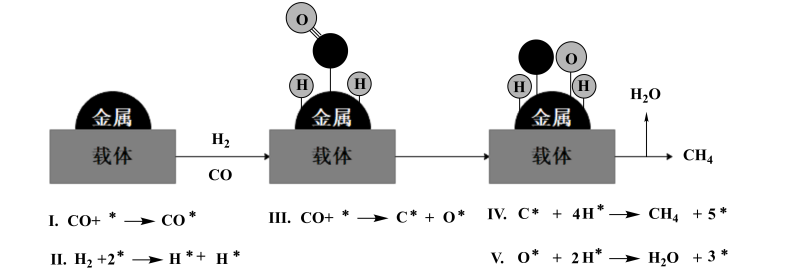
在某一条件下进行CO加氢甲烷化,发生i、ii和iii反应,相关数据如下:
体积/L | CO | CO2 | H2 | H2O | CH4 |
反应前 | 10 | 10 | 80 | 1.0 ×10-7 | 1.0 ×10-7 |
反应后 | 1.0 ×10-6 | 10 | x | 10 | 10 |
①x=(保留2位有效数字);
②此条件下反应iii的平衡常数K= 100,通过计算判断反应iii是否平衡。
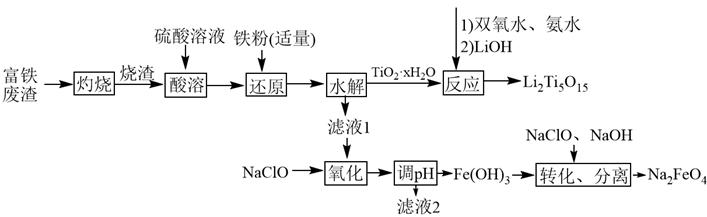
已知: 、
、
,溶液中离子浓度
时认为该离子沉淀完全。回答下列问题:
微信扫码预览、分享更方便