C(s) + O2(g) = CO2(B) △H=-393.5kJ/mol
2C(g) + O2(g) = 2CO(g) △H=-221kJ/mol
则:2NO(g) + 2CO(g) = N2(g) + 2CO2(g) △H=。

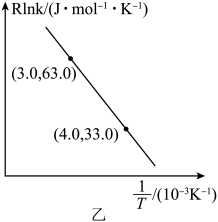
①温度: T1 T2( 填“<”或“>”) 。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=(保留小数点后两位)。用CO的浓度变化表示起始到平衡的平均反应速率V(CO)=。
①肼的电子式为。
②肼能与酸反应。N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H62++H2O = N2H5++H3O+平衡常数K1
N2H5++H2O= N2H4+H3O+平衡常数K2
相同温度下,K1>K2 , 其主要原因有两个:
a.电荷因素,N2H5+水解程度小于N2H62+;
b.。
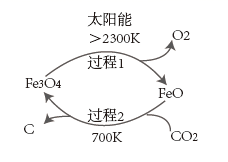
已知①
②
则过程2的热化学方程式为。
| 容器 | 起始物质的量 | | |||
| | | | | ||
| Ⅰ | 0.2 | 0.2 | 0 | 0 | 50% |
| Ⅱ | 0.2 | 0.1 | 0.2 | 0.3 | / |
容器Ⅰ在10min时反应达到平衡,该段时间内 的平均反应速率为
;容器Ⅱ起始时反应向(填“正反应方向”、“逆反应方向”或“不移动”)进行。
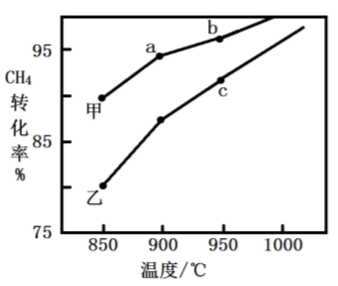
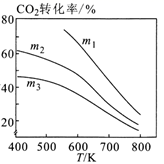
①图1中 、
、
最高的是。
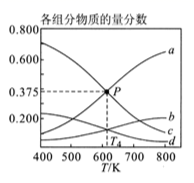
②图2表示在总压为P的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。
温度时,列式表示该反应的压强平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
|
实验 |
操作与现象 |
|
① |
|
|
② |
|
|
③ |
|
分析上述实验现象,所得结论不合理的是
化学键 | ||||
键能 | 803 | x | 463 | 436 |