
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是.
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式.
③当停止通入SO2 , 熄灭酒精灯后,需要继续通一段时间的氧气,其目的是.
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
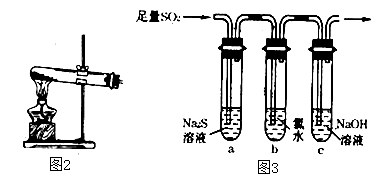
①能说明二氧化硫具有氧化性的实验现象为.
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为.