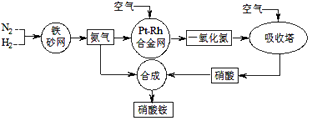

①曲线a对应的温度是。
②关于工业合成氨的反应,下列叙述正确的是。
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.如果N点时c(NH3)=0.2 mol·L-1 , N点的化学平衡常数K≈0.93
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
③在上面右图中画出第二步反应的平衡常数K随温度的变化的示意图 。