CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的副反应有乙醇在浓硫酸存在下140℃时脱水生成乙醚。
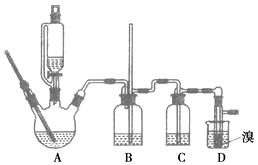
用少量的溴和足量的乙醇反应制备1,2二溴乙烷的装置如图所示:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
请回答下列问题:
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇