反应1:C(s)+O2(g)=CO2(g) △H1=-394kJ/mol
反应2:2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
反应3:2C(s)+O2(g)=2CO(g) △H3
①设y=△H-T△S,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是。
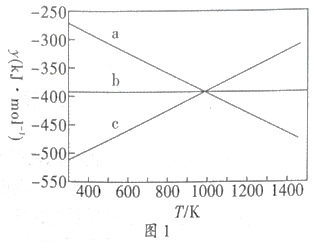
②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比(填标号)。
A.不变 B.增大 C.减小 D.无法判断
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则用分压表示反应的平衡常数K的数值为。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为。
反应1:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1<0
反应2:CO2(g)+H2(g)CO(g)+H2O(g) △H2>0
将1molCO2和3molH2的混合气体充入体积为VL的密闭容器中,相同时间内测得温度与转化率产物选择性的关系如图2所示,CO2平衡转化率随压强变化如图3所示。
CH3OH选择性=
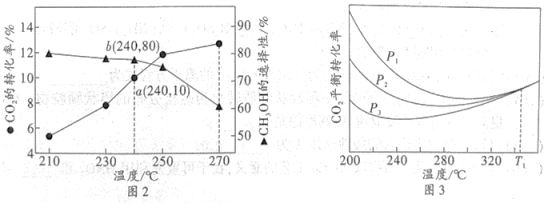
①240℃该反应达到平衡时,产生的CH3OH的物质的量为。
②如图3所示,温度为T1℃时,三条曲线几乎交于一点,分析其原因:。