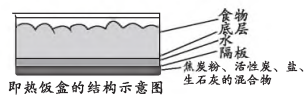
该即热饭盒“起热”原因主要与(填化学方程式)反应为放热反应有关。
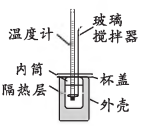
①实验中玻璃搅拌器的使用方法为(填“上下移动”、“左右移动”或“匀速旋转”)。
②实验中碱稍过量的原因为。
③实验测得反应前后体系的温度值分别为℃、
℃,则该过程放出的热量为J[c和ρ分别取4.18J/(g⋅℃)和1.0 g⋅mL
, 忽略水以外各物质吸收的热量,下同];实验发现,若用同体积同浓度的醋酸溶液代替实验中的盐酸,(
)℃减小,其原因为(用化学用语表示)。
序号 | 反应试剂 | 体系温度/℃ | ||
反应前 | 反应后 | |||
ⅰ | 0.20 mol·L | 1.36 g Zn | 25 | b |
ⅱ | 0.65 g Zn | 25 | c | |
①实验中应选择(填“Zn粉”或“Zn片”);温度:bc(填“>”“<”或“=”)。
②当时表明该方法可行。(保留1位小数)