1.
(2023高三上·晋城期中)
氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
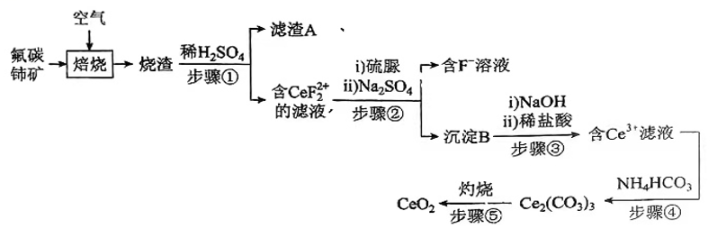
已知:①稀土离子易与SO42-形成复盐沉淀,Ce3+和SO42-发生反应: ;
;
②硫脲: 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+ , 两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
-
-
-
(2)
在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式。
-
-
(3)
焙烧后加入稀硫酸浸出,为提高Ce的浸出率,需控制硫酸浓度不能太大的原因是。
-
-
(4)
加入硫脲的目的是将CeF22+还原为Ce3+ , 反应的离子方程式为。
-
-
(5)
步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为。
-
-
(6)
下列关于步骤④的说法正确的是____(填字母)。
A . 该步骤发生的反应是 B . 可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度
C . 过滤时选择减压过滤能够大大提高过滤效率
D . 过滤后的滤液中仍含有较多Ce3+ , 需要将滤液循环以提高产率
B . 可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度
C . 过滤时选择减压过滤能够大大提高过滤效率
D . 过滤后的滤液中仍含有较多Ce3+ , 需要将滤液循环以提高产率
-
-
(7)
取所得产品7.00gCeO
2溶解后配成250mL溶液。取25.00mL该溶液用0.20mol.L
-1硫酸亚铁铵【(NH
4)
2Fe(SO
4)
2】溶液滴定,滴定时发生反应

, 达到滴定终点时消耗硫酸亚铁铵溶液18.50mL,则该产品的纯度为
。(保留三位有效数字)。
-

;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;