已知:己二酸的物理常数如下表所示。
|
|
色态 |
相对分子质量 |
熔点/℃ |
溶解性 |
|||
|
己二酸 |
白色晶体 |
146 |
152 |
g/100 mL水 |
乙醇 |
||
|
15℃ |
25℃ |
100℃ |
易溶 |
||||
|
1.4 |
2.3 |
160 |
|||||
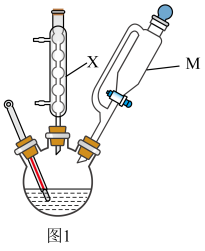
Ⅰ.制备:向三颈烧瓶中,先加入一定量的浓 , 再通过仪器M向三颈烧瓶中缓缓加入环己醇,保持80℃持续反应2h。
Ⅱ.提纯:冷却后,抽滤、洗涤、干燥得己二酸粗品。
Ⅲ.测定粗品纯度:精确称取粗品0.0146 g于锥形瓶中,加入适量蒸馏水溶解,加入合适指示剂,用0.01 mol/L的NaOH标准液滴定至终点,重复上述操作三次,平均消耗NaOH标准液的体积为V mL。
实验原理: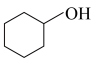
(未配平)。
回答下列问题:
a.热水 b.冰水 c.乙醇

重复上述操作三次,记录另两次数据如表中所示:
|
滴定次数 |
初读数/mL |
末读数/mL |
|
第二次 |
1.20 |
17.60 |
|
第三次 |
5.10 |
23.40 |
最终所得己二酸粗品的纯度为。