①在(CH3)3SiCl、(CH3)3SiF、(CH3)4Si中,C-Si-C键角最大的是,原因是。
②C5H表示环戊二烯负离子,已知分子中的大π键可用符号π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
),则C5H
中的大π键应表示为。
③该铁的配合物中碳原子的杂化方式共有种。

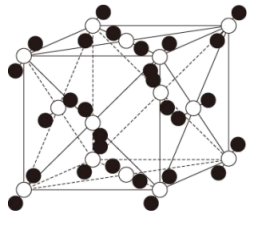
①普鲁士蓝中Fe2+与Fe3+个数之比为;该晶胞的化学式为。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为pm;该晶体的密度为g•cm-3(阿伏加德罗常数为NA)。
在催化剂的作用下,氢气还原的过程中可同时发生反应①②。
①
②
总压/ | ||||||
起始 | 0.5 | 0.9 | 0 | 0 | 0 | |
平衡 | m | 0.3 | p |
已知 , 则表中
;反应①的平衡常数
(用含p的代数式表示),
为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
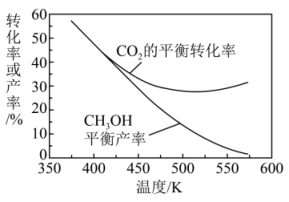
图中500K以后,的平衡转化率随温度升高而增大的原因是。