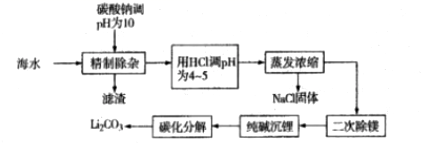
已知:①海水中某些离子浓度如下:
| 离子 | Li+ | Mg2+ | Ca2+ | Mn2+ | Cl- |
| 浓度(mol/L) | 0.113 | 0.049 | 0.001 | 0.010 | 0.501 |
②碳酸锂的溶解度:
| 温度(℃) | 0 | 10 | 30 | 50 | 70 | 90 |
| 溶解度(g/L) | 1.54 | 1.43 | 1.25 | 1.08 | 0.91 | 0.83 |
几种难溶电解质的溶度积(25℃):
| 物质 | Li2CO3 | MgCO3 | MnCO3 | CaCO3 | Mg(OH)2 |
| Ksp | 2.5×10-2 | 6.8×10-6 | 2.3×10-11 | 2.8×10-9 | 6×10-10 |
请回答下列问题:
|
序号 |
| 沉淀质量(g) | Li2CO3含量(%) | 锂回收率(%) |
| 0.9:2.0 | 10.09 | 92.36 | 77.67 | |
| 1.0:2.0 | 10.97 | 90.19 | 82.46 | |
| 1.1:2.0 | 11.45 | 89.37 | 85.27 | |
| 1.2:2.0 | 12.14 | 84.82 | 85.85 |
综合以上信息及考虑实际生产时的原料成本,应按照 填序号
中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。