①该反应的平衡常数表达式为K=。
②下列各项中,不能够说明该反应已达到平衡的是(填序号).
A.2v正(H2)=v逆(CO)
B.一定条件下,单位时间内消耗2molH2 , 同时生成1molCH3OH
C.恒温、恒容时,容器内的压强不再发生
D.恒温、恒容时,容器内混合气体的密度不再变化
E.混合气体的平均相对分子质量不随时间而变化
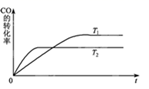
①该反应的ΔH0(填“<”、“>”或“=”)。
②T1和T2温度下的平衡常数:K1K2(填“<”、“>”或“=”)。
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式。
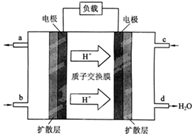
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为