|
序号 |
V(过氧化氢溶液)/mL |
V(氯化铁溶液)/mL |
二氧化锰质量/g |
反应温度/℃ |
V(水)/mL |
结论 |
|
1 |
10 |
2 |
0 |
50 |
8 |
|
|
2 |
10 |
2 |
0 |
30 |
8 |
|
|
3 |
10 |
0 |
1 |
30 |
a |
①实验1、2研究的是对 分解速率的影响。
②表中数据a的值应该为;实验2、3研究的是对 分解速率的影响。
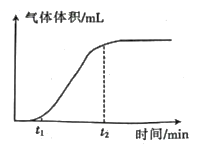
③如果实验3中30s时共收集到气体的体积为11.2mL(已折算成标准状况下),则用过氧化氢表示的0~30s的平均反应速率为 。
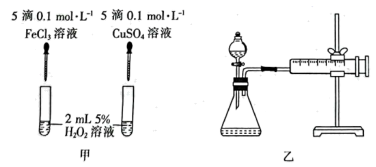
①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是。