①NH3与Cu2+形成配合物的能力大于Mg2+的原因为。
②溶液中的水存在H3O+、 等微粒形式,
可看作是H3O+与H2O通过氢键形成的离子,则
的结构式为。
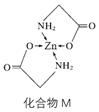
①1 mol M含有的σ键的数目为。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、 等,NH3的分子空间构型为,
的中心氮原子杂化方式为。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
|
卤化锌/ ZnX2 |
ZnF2 |
ZnCl2 |
ZnBr2 |
|
熔点/℃ |
872 |
283 |
394 |
则ZnX2熔点如表变化的原因是。
