合成氨是人类科学技术上的一项重大突破,曾三次获诺贝尔化学奖:
1918年弗里茨·哈伯因发明用氮气和氢气合成氨的方法获得诺贝尔化学奖,
1931年卡尔·博施因改进合成氨的方法获得诺贝尔化学奖,
2007年格哈德·埃特尔因发现了哈伯-博施法合成氨的作用机理获得诺贝尔化学奖。 和
在固体催化剂(Fe)表面合成氨的过程可用下图表示:
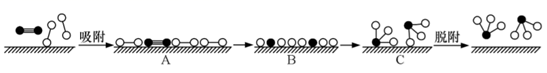
(图中 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 分别表示
分别表示 、
、
和固体催化剂);反应历程如下(*表示吸附态):
吸附: ;
。
表面反应: ;
;
。
脱附: 。
其中, 的吸附分解反应活化能高、反应速率慢,决定了合成氨的整体反应速率。

①有利于提高 平衡转化率的方法有(填字母)。
A.增大 的浓度 B.采用合适的催化剂
C.在高压下进行反应 D.在较高温度下进行反应
②其他条件相同,不同压强下在刚开始反应时反应物活化分子浓度较大的是(填“ ”、“
”或“
”)。
①从化学平衡角度看, 和
物质的量之比为1:3时平衡转化率最高。请分析实际生产中适当提高原料气中
比例的两个理由:、。
②据悉,日本某工厂选择了在700℃下合成氨,请(从化学动力学的角度)分析该厂选择合成温度为700℃的理由:。
③工业生产中同时还采用“不断将氨液化并移去液氨”的措施来提高合成氨产率,请分析采取该措施的原因:。