|
催化剂 |
Ru |
Rh |
Ni |
Pt |
Pd |
Fe |
|
初始速率 |
7.9 |
4.0 |
3.0 |
2.2 |
1.8 |
0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②温度为T时.在恒容的密闭容器中加入2molNH3此时压强为p0用Ru催化氨气分解,若平衡时氨气的转化率为50%.,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
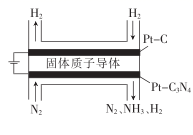
①Pt—C3N4 , 电极上产生NH3的电极反应式为。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:。