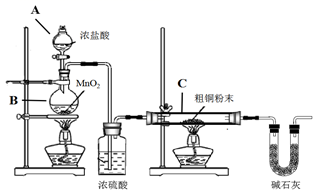
① B装置中发生反应的化学方程式是
② 装置C中粗铜粉末(含杂质Fe)与气体充分反应时的生成物是
③ 反应完成后,将C中的固体用稀盐酸完全溶解,再调节pH值除杂,经一系列操作便可获得CuCl2·2H2O晶体。溶解C中生成物固体时,有时会加入少量双氧水,目的是
已知: ![]()
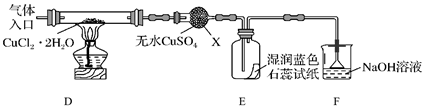
④仪器X的名称是
⑤实验操作的先后顺序是a→→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
⑥装置F中NaOH溶液的作用是。
⑦ 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。请分析产生CuCl2杂质的原因是