I.
Ⅱ.
回答下列问题:
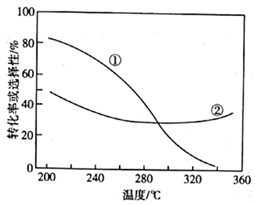
已知: 的选择性=
×100%。其中表示平衡时
的选择性的是曲线(填"①"或"②");温度高于 300℃时,曲线②随温度升高而升高的原因是;为同时提高 CO2的平衡转化率和平衡时
的选择性,应选择的反应条件为(填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
①为提高 CH3OCH3的平衡产率,可以采取的措施有(任写一条)。
②473 K时,在密闭容器中加入一定量 CH3OH(g),采用合适的催化剂进行反应,达到平衡时体系中 CH3OCH3(g)的物质的量分数为(填标号)。
a.< b.
c.
~
d. >
①降低温度,k正-k逆(填"增大"、"减小"或"不变");
②在TK、101kPa下,按照 投料,CO2转化率为50%时,
,用气体分压表示的平衡常数 Kp=。