①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3mol•L﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
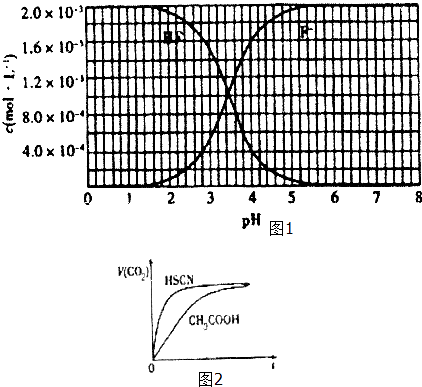
请根据以下信息回答下列问题:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
ⅰ.CO(g)+2H2(g)CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ. CO2(g)+H2(g)CO(g)+H2O(g) ΔH=-c kJ/mol。
回答下列问题:
①下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍
②该反应达到平衡时,其他条件不变,通入CO2时,则v(正)(填“>”“<”或“=”)v(逆),平衡常数(填“变大”“变小”或“不变”)。
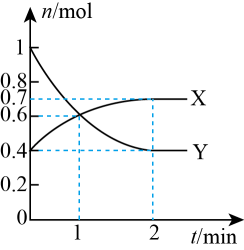
①Y为(填化学式)。
②0~1min时v(CO)为mol/(L·min)。
③该温度下,该反应的平衡常数Kc=。
①简单离子半径:X>D
②简单氢化物的稳定性:X<E
③B的氧化物对应的水化物都是强酸
④D和E的简单离子在水溶液中不能大量共存
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2 , 含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
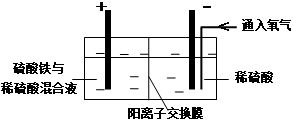
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是。(使用化学用语作答)