氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。研究氮氧化物性质与转化,对于降低氮氧化物对环境的污染有重要意义。
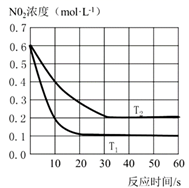
①T1温度下,0~10s内,O2的反应速率v(O2)=。
②在T2温度下,该反应的平衡常数KT2=,当反应达到平衡时,继续向容器中充入c(NO2)=0.1mol•L-1、c(NO)=0.2mol•L-1、c(O2)=0.1mol•L-1。此时正逆反应的速率大小关系是v正v逆(填“>”、“<”或“=”)。
③下列说法正确的是。
A.该反应正反应的活化能小于逆反应的活化能
B.使用合适的催化剂可以提高NO2的平衡转化率
C.平衡状态下,若充入NO,则达到新平衡时,正、逆反应速率都增大
D.平衡状态下,若保持温度不变,将容器体积增加一倍,则平衡逆向移动,反应物浓度增大
上述反应分两步完成,其反应历程如图所示。
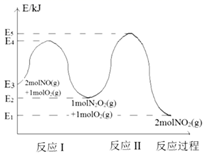
请回答下列问题:
反应Ⅰ和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是(填“反应Ⅰ”或“反应Ⅱ”),请写出判断的理由。