相关化学键的键能如下表所示:
|
化学键 |
Cl—Cl |
N≡O(NO气体) |
Cl—N |
N=O |
|
键能/(kJ·mol-1) |
243 |
630 |
200 |
607 |
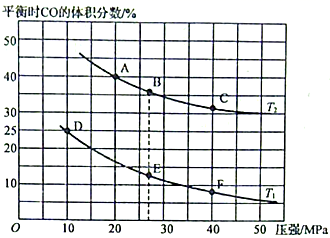
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的点(填标号)。
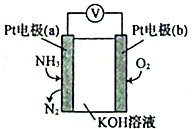
①电极b上发生的是反应(填“氧化”或“还原”)。
②电极a的电极反应为。