Sabatier 反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
水电解反应:2H2O(l) 2H2(g)+O2(g)
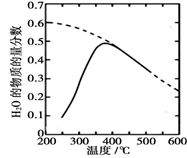
①该反应的平衡常数 K 随温度升高而(填“增大”或“减小”)。
②温度过高或过低均不利于该反应的进行,原因是。
③下列措施能提高 CO2 转化效率的是(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中 CO2 所占比例
E. 合理控制反应器中气体的流速
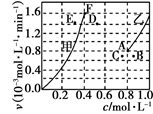
为了探究该反应的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2 与CH4 ,使其物质的量浓度均为1.0mol·L-1 , 平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图, v正~ c(CH4)和 v逆 ~ c(CO)。则与 v正~ c (CH4)相对应曲线是图中(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为(填“D”“E”或“F”)。
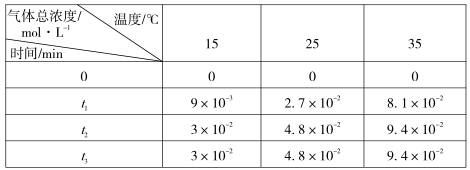
氨基甲酸铵分解反应是(填“放热”或“吸热”)反应。15℃时此反应的化学平衡常数 K =。
① 已知 CO2(g)、H2O(g)的生成焓分别为–394 kJ∙mol-1 、–242 kJ∙mol-1 , Bosch 反应的Δ H =kJ∙mol-1(生成焓指一定条件下由对应单质生成 1mol 化合物时的反应热)。
②一定条件下 Bosch 反应必须在高温下才能启动,原因是。
③该新方案的优点是。