实验一:高温分解FeSO4 , 利用如图1所示的实验装置进行实验.
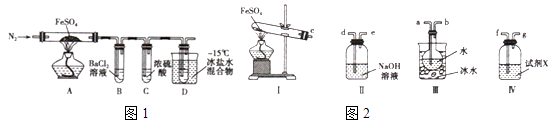
已知:①SO2熔点为﹣72℃,沸点为﹣10℃②SO3熔点为﹣16.8℃,沸点为44.8℃
实验二 探究高温分解 FeSO4生成的气体
①按气流方向连接各仪器,用字母表示接口的连接顺序:c﹣
②试剂X的名称是
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量 g.