利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中H2O2的溶质质量分数为3%,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比.反应放热忽略不计。)
(1)写出装置中发生反应的化学方程式: 2H2O2 2H2O+O2↑ ,MnO2在此反应中起 作用。
2H2O+O2↑ ,MnO2在此反应中起 作用。
(2)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出 。
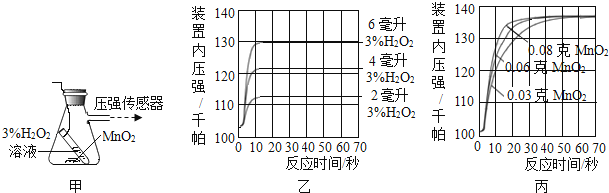
(3)当用“3%H2O2溶液8毫升与不同质量的MnO2混合”时,得到如图丙所示的曲线.曲线的斜率显示,当MnO2的用量增加到0.08克时,分解速度达到实验要求。在此实验条件下,若MnO2的质量有4克(一药匙),就能使如图 (选填字母)烧杯中所装的3%H2O2溶液,其分解速度最接近实验要求。