|
非金属性 |
熔点 |
沸点(同压) |
键能 |
|
PS |
MgO CaS |
CF4 SiCl4 |
H-ClH-Br |
①N、H、O的电负性从小到大的顺序为。
②NH2OH中N原子的杂化类型为。
③NH₂OH极易溶于H2O,除因为它们都是极性分子外,还因为。
电池装置 |
|
|
|
|
编号 | a | b | c | d |
①上述四种电池中,属于二次电池的是(填序号,下同),属于干电池的是。
②a装置中,外电路中电子的流向是(填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若电解质改为碱性介质,则负极的电极反应式为。
①该电池的电解质溶液可以是。
②当外电路中转移1mol e-时,电解质溶液增加的质量是g。
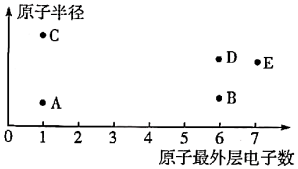
a.E的简单氢化物的稳定性比D的强
b.D的氧化物对应的水化物的酸性比E的弱
c.D的单质常温下为固体,E的单质常温下为气体
d.将E的单质通入D的简单氢化物的水溶液中,有D的单质生成
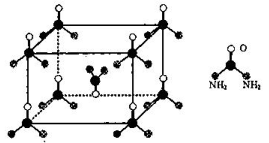
① 中基态中心离子的核外电子排布式是,
的空间结构是。
②实验发现,其他条件相同时,乙醇溶液浓度越大,析出的三硝酸六尿素合铁(Ⅲ)晶体越多。其原因是。