实验操作 | 现象 | 结论 | |
A | 将少量的饱和硼酸溶液滴加到碳酸钠溶液中 | 无气泡 | Ka2H2 CO3>H3BO3 |
B | 向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制备的Cu(OH)2悬浊液并加热 | 无红色沉淀 | 蔗糖未水解 |
C | 将浸透了石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片,并加强热,将生成的气体通入酸性高锰酸钾溶液 | 溶液褪色 | 石蜡油分解产物中含有不饱和烃 |
D | 向1mL2mol/L的NaOH溶液中,滴加1-2滴1mol/ L MgCl2溶液,再滴加2滴1mol/ L FeCl3溶液 | 先有白色沉淀,后有红褐色沉淀 | Ksp:Mg(OH)2>Fe(OH)3 |
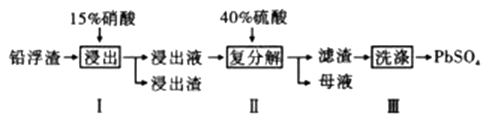
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
A.稀硫酸
B.稀盐酸
C.硝酸铅溶液
D.酒精
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。

写出该反应的热化学方程式。
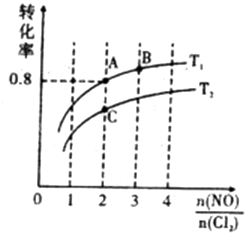
图中T1、T2的关系为:T1T2 (填“>”、“<”或“=”)

①嘌呤中所有元素的电负性由大到小的顺序。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③吡啶结构中N原子的杂化方式。
④分子中的大π键可用符号π 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有个紧邻的分子。
②在CO转化成CO2的反应过程中,下列说法正确的是。
A.分子中孤电子对数不变
B.分子的极性发生变化
C.原子间成键方式发生改变
D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因。

聚对萃二甲酸乙二醇酯(PET俗称涤纶树脂,是一种重要的有机高分子材料。其结构为  。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

根据题意回答下列问题:

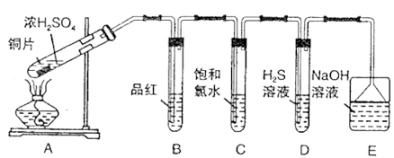
请回答下列问题:
请简述理由:。
)溶液X中一定大量含有的金属阳离子是,简述如何检验溶液X中该离子。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
(填仪器名称)中;滴定终点的现象为。
②气体Y中SO2的物质的量分数为。