①恒容时发生反应:A(g)+B(g)⇌3C(g)
②恒压时发生反应:A(g)+B(g)⇌2C(g)
③恒容时发生反应:A(g)+2B(g)⇌2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)⇌3C(g)J﹣D(s)

t/s | 0 | 5 | 15 | 25 | 35 | |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
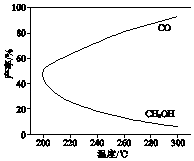
CO2(g)+3H2(g)⇌H3OH(g)+H2O(g)△H1 ,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 .
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将,该反应的化学反应速率将(填“增大”“减小”或“不变”).
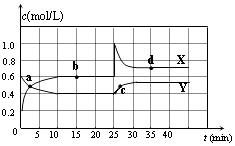
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值 0.08mol•L﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是,表中5min~6min之间数值发生变化,可能的原因是.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣53.7kJ•mol﹣1 Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 Ⅱ
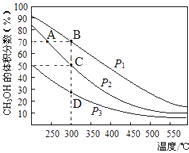
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJ•mol﹣1和﹣285.8kJ•mol﹣1 .
②H2O(1)═H2O(g)△H3=44.0kJ•mol﹣1
请回答(不考虑温度对△H的影响):
在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图.
请运用化学反应原理的相关知识研究元素及其化合物的性质.
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣116KJ•mol﹣1
又知:CO(g)+O2(g)═CO2(g)△H2=﹣283KJ•mol﹣1
H2(g)+O2(g)═H2O(g)△H3=﹣242KJ•mol﹣1
H2(g)+ O2(g)═H2O(g)△H4=﹣286KJ•mol﹣1
则甲醇的燃烧热为 .
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2 , 5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为 ;下列措施中有利于增大该反应的反应速率且提高转化率的是 .
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
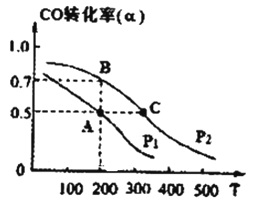
(3)在密闭容器中充有10mol CO与20mol H2 , 在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tc(填“大于”、“小于’’或“等于“).
②若A点时容器的体积为10L,该温度下B点的平衡常数K= .
(4)Na2SO3的水溶液呈 (填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示): ;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程
(已知:Ksp(CaSO3)=1.4×10﹣7 , Ksp(CaCO3)=2.8×10﹣9).