 制蒸馏水
C .
制蒸馏水
C . 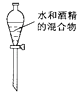 分离水和酒精
D .
分离水和酒精
D . 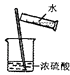 稀释浓硫酸
稀释浓硫酸
①四氯化碳 ②汽油 ③酒精 ④苯 ⑤甲苯
已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
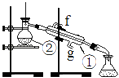
实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.②静置分层后,旋开活塞,用烧杯接收下层液体
(12分)铝是应用广泛的金属.以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
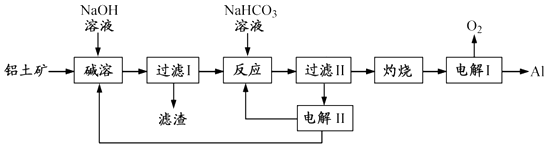
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.
“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.

阳极的电极反应式为,阴极产生的物质A的化学式为.