N2(g)+ | 3H2(g) | 2NH3(g) | |
起始浓度/mol·L-1 | 1.0 | 3.0 | 0.2 |
2 s末浓度/mol·L-1 | 0.6 | 1.8 | 1.0 |
4 s末浓度/mol·L-1 | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )

【实验目的】测定锌与稀硫酸反应的速率
【实验用品】锥形瓶、双孔塞、胶皮管、分液漏斗、直角导管、50mL注射器、铁架台、秒表、锌粒、1 mol/L硫酸、4 mol/L硫酸。
【实验步骤】
①取一套装置(如图所示),加入40 mL 1 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
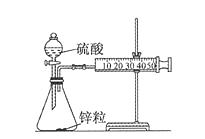
②取另一套装置,加入40 mL4 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
加入试剂 | 反应时间 | 反应速率 |
40 mL 1 mol/L硫酸 | 长 | |
40 mL 4 mol/L硫酸 | 短 |
①锌的颗粒(即表面积)大小;
②40 mL的硫酸要迅速加入;
③装置,且计时要迅速准确;
④气体收集可以用排水量气装置(如图所示)代替。

①。
②。