实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法不正确的是:( )
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为,
②该温度下平衡常数K= 。
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
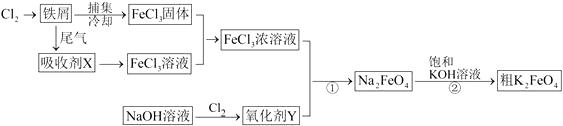
请回答下列问题:
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生反应
c.Fe3+与 S2-发生互促水解反应
依据预测a 写出该反应的离子方程式
在进行实验验证前,先进行资料收集,得到如下信息:
物质 | 颜色 | 水中溶解性 |
Fe2S3 | 黑色 | 难溶于水 |
FeS | 黑褐色 | 难溶于水 |
进行如下实验:
实验步骤 | 操作 | 现象 | 备注 |
① | 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 | 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
② | 继续滴加3滴0.1 mol/L 硫化钠溶液 | 同上 | |
③ | 继续滴加0.1 mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 | 操作 | 现象 |
④ | 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
⑤ | 继续滴加3滴0.1 mol/L 氯化铁溶液 | 同上 |
⑥ | 继续滴加0.1 mol/L 氯化铁溶液至过量 | 同上 |