 向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
物质 | X | Y | Z |
初始浓度/mol•L﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/mol•L﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
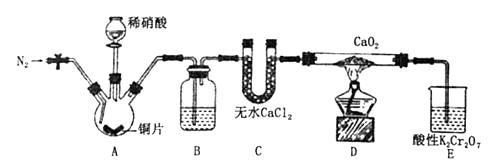
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2 .
请回答下列问题:
a.向装置中通入N2 b.向三颈烧瓶中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入氮气 f.关闭分液漏斗旋塞
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化、滴定
在碘量瓶中将因氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+(该反应放热),在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2═2I﹣+S4O
)
回答下列问题:
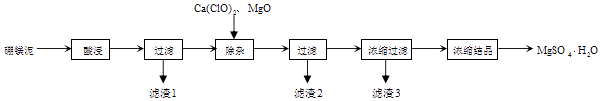
硼镁泥的主要成分如表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
资料:B2O3溶于水形成硼酸,由于硼酸易溶于水,溶解度随温度的升高而升高,而硫酸镁在80℃溶解度最大,所以常规方法很难将二者分离,目前常采用高温结晶法
回答下列问题:
A.取上层清液,滴加苯酚试液不显紫色
B.取上层清液,滴加KSCN,不变红
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀