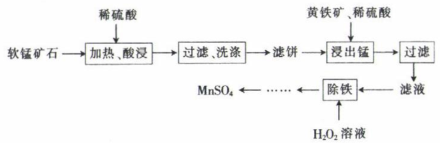
已知:①软锰矿石的主要成分为MnO2 , 杂质主要为Mg、Ca、Fe的氧化物,MnO2与稀硫酸不反应;
②黄铁矿的主要成分为FeS2;
③CaSO4微溶于水。
回答下列问题:
a.砝码生锈
b.溶解时有液体溅出
c.定容时俯视刻度线
d.摇匀后发现液面低于刻度线,继续加水至刻度线
实验室中,钠单质保存在煤油中以隔绝空气和水,钠与水反应的化学方程式为。
猜想1:生成的H2使KMnO4溶液变为浅绿色。
猜想2:生成的NaOH使KMnO4溶液变为浅绿色。
甲同学设计如图装置进行实验。
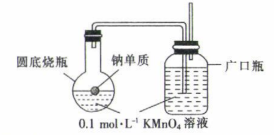
①实验过程中观察到圆底烧瓶内溶液变为浅绿色,广口瓶内溶液颜色,证明猜想1错误。
②乙同学认为甲同学的方案不严谨,理由是随着反应进行,圆底烧瓶内的温度会升高,干扰实验。为了排除温度对实验的干扰,可以进行的改进措施有。
③丙同学取适量0.1mol·L-1的KMnO4溶液于试管中,滴加NaOH溶液,发现溶液变为浅绿色(浅绿色为溶液中的颜色)并有气泡产生,证明猜想2正确,该反应的离子方程式为。