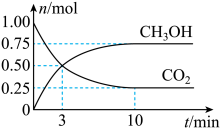
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测得 |
| 2 | 向 |
| 3 | 向2中所得溶液中继续加入 |
| 4 | 向3中所得溶液中继续加入 |
下列说法正确的是( )
A. B.
B. C.
C. D.
D.
将实验一中的HAc溶液和与其等浓度的(简写为NaAc)溶液按一定体积比混合,测pH。
序号 | V(HAc)/mL | V(NaAc)/mL |
| pH | |
Ⅰ | 40.00 | 0 | 2.86 | ||
Ⅱ | 4.00 | 36.00 | 0 | 3.36 | |
… | |||||
Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |
根据表中信息,补充数据:a=,b=。
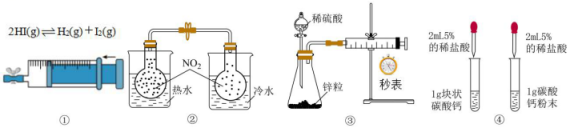
已知:不溶于水且不与盐酸反应;
能与NaOH溶液反应,生成可溶性盐。
请回答下列问题。
氧化亚铜()可用于电镀工业。干法生产
粉末的主要工艺流程如下:

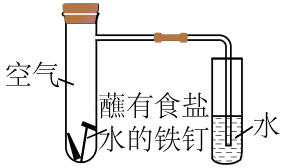
①该实验为(填“析氢”或“吸氧”)腐蚀。
②实验进行一段时间后,在右侧小试管中,可观察到的现象为。
③在左侧大试管中,正极上发生反应的电极反应式为。

①a为电源的(填“正极”或“负极”),判断的理由为。
②电镀时,Fe电极上发生反应的电极反应式为。
③电镀过程中,电解质溶液的pH将(填“增大”、“减小”或“不变”)。
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为g(假设起始两电极的质量相等)。