
甲 乙
图乙中若分液漏斗滴液速度过快,部分会参与A中反应并产生大量氮气,降低产品产率,该过程中反应生成氮气的化学方程式为。充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。
实验3:测定馏分中水合肼的含量
①该实验滴定终点的判断:
②滴定操作中若不加入适量固体,则测量结果会(填“偏大”“偏小”“无影响”)。
③下列能导致馏分中水合肼的含量测定结果偏高的是(填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
④实验测得消耗溶液的平均值为20.00mL,馏分中水合肼(
)的质量分数为。

相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | |||||||
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
已知:①;
②;
③。
则催化还原反应。
M极接电源的极,N极的电极反应式为。

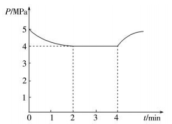
①下列描述能说明反应达到平衡状态的是
A.
B.体系中混合气体密度不变
C.体系中NO、CO的浓度相等
D.混合气体的平均相对分子质量不变
E.单位时间内消耗nmol的NO同时消耗nmol的
②2min时NO的转化率为。
③时的平衡常数
(
为以平衡分压表示的平衡常数,平衡分压=总压
物质的量分数)。若在4min改变的条件为升高温度,
减小,则a0(填“大于”“小于”或“等于”)。
其中能量最低的是______(填字母)。
的键角比
的键角(填“大”或“小”)
图甲  图乙
图乙
①1mol三氮唑中所含键的数目为mol;碳原子杂化方式是;
②三氮唑的沸点为 , 与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为
, 前者沸点较高的原因是。
