选项 | 实验目的 | 实验操作及现象 | 结论 |
A | 制备Fe(OH)3胶体 | 向沸水中逐滴加入5~6滴饱和FeCl3溶液,持续加热,生成红褐色固体 | FeCl3与水反应产生Fe(OH)3胶体 |
B | 验证Cl2的漂白性 | 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃瓶。一段时间后有色鲜花褪色 | Cl2有漂白性 |
C | 检验溶液中的Na+ | 用硫酸洗净后的铂丝蘸取少量溶液在酒精灯外焰上灼烧,产生黄色火焰 | 溶液中存在Na+ |
D | 探究Na2O2与水反应的产物 | 将1~2mL水滴入盛有1~2g固体的试管中,滴入2滴酚酞试液,溶液先变红后褪色 | 反应可能生成了NaOH和H2O2 |
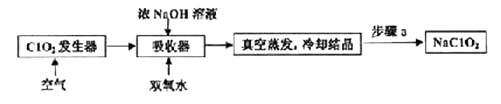
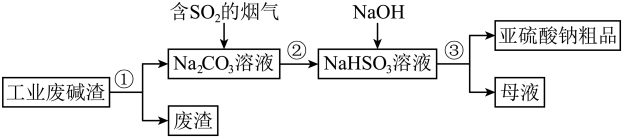
过程①进行![]() 操作是。
操作是。
【进行实验】
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实验1 |
| 向2支试管中分别加入少量 | 2支试管中均有气泡产生 |
实验2 |
| 向Ⅱ中加入试剂a,向Ⅰ中加入少量 |
|
②称量固体168g,加热一段时间之后,剩余固体的质量为137g,则剩余固体中
与
的物质的量之比为。
实验3 | |||||
浓度/ | 0.01 | 0.10 | 0.50 | 0.01 | |
0.01 | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 | |
0.10 | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
0.50 | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
已知:易溶于水。
根据实验3,鉴别浓度均为0.50的
和
的方法是:分别取等量溶液置于两试管中,。
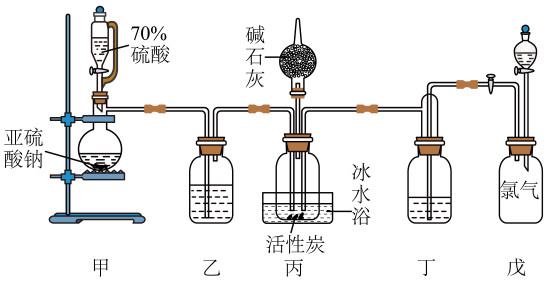
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.盐酸

已知1:还原性:碘离子大于亚铁离子
已知2:碘化银、溴化银和氯化银一样,难溶于水
回答下列问题:

①加入Fe粉进行转化反应的离子方程式为。
②通入的过程中,若氧化产物只有一种,反应的化学方程式;若反应物用量比
时,氧化产物为;当
后,单质碘的收率会降低,原因是。