| 实验方案 | 现象 | 结论 |
A | 向H2O2溶液中滴入几滴FeCl3溶液,并在试管口放置带火星的木条 | 带火星的木条复燃 | FeCl3能催化H2O2分解产生O2 |
B | 向滴有酚酞的NaOH溶液中通入SO2 | 溶液的红色褪去 | SO2具有漂白性 |
C | 向盛有少量Na2SO3固体、NaBr固体的两支试管中分别加入等量浓H2SO4 | 分别产生无色和红棕色的刺激性气味气体 | 氧化性:Br2>SO2 |
D | 向Na2S溶液中依次加入几滴酸性KMnO4溶液、BaCl2溶液 | 产生大量白色沉淀 | S2-能被 |
①下列相关说法正确的是。
A.该化合物中NH3的中心原子的杂化轨道类型为sp3
B.该化合物中存在的化学键有离子键、共价键、配位键和氢键
C.组成该化合物的元素N、O、S中,第一电离能最大的是N
D.根据VSEPR模型预测的的空间结构是正四面体形
②比较键角∠H-N-H的大小:NH3[Cu(NH3)]2+(填“>”或“<”),理由是。

已知:亚硝酰氯有毒,沸点-5.5℃,分子中各原子均满足8电子稳定结构。
请回答:
反应Ⅰ:CO2(aq)+H2O(l)(aq)+H+(aq) K1=4.5×10-7
反应Ⅱ:(aq)
(aq)+H+(aq) K2= 4.7×10-11
反应Ⅲ:CaCO3(s)Ca2+(aq)+
(aq) K3=3.4×10-9
请回答:


其中步骤①实验装置如图所示:

已知:
(I)多聚甲醛为(CH2O)n(n=6~100),当n<12的多聚甲醛可溶于水,当n≥12则不溶于水;加酸或160~200℃加热时会解聚。
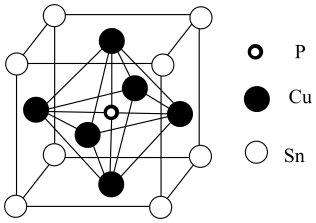
(Ⅰ)[Fe(CO)2Cl2]遇氧气、水都会反应,其中Fe的化合价为+2价。
(Ⅱ)SnCl2有强还原性,可被弱氧化剂HgCl2氧化:2HgCl2+SnCl2=Hg2Cl2↓+SnCl4
请回答:

c→→a→→→f
a.将准确称量的[Fe(CO)2Cl2]溶解于水
b.准确称量Na2C2O4并配制一定物质的量浓度的溶液,进行滴定
c.将制备的KMnO4溶液加热煮沸,冷却后滤去MnO2
d.用HgCl2除过量的SnCl2 , 滤去沉淀
e.加入足量SnCl2进行还原
f.用Na2C2O4标准溶液标定后的KMnO4溶液进行滴定
下列情况会导致测量结果偏大的是。
A.[Fe(CO)2Cl2]产品含少量多聚甲醛杂质
B.过量的SnCl2未被除尽
C.[Fe(CO)2Cl2]产品部分氧化或潮解
D.配好的KMnO4标准溶液久置后使用

已知:
(Ⅰ)R1-OHR1-X;
(Ⅱ)R2COOHR2-COX;
(Ⅲ)R-COXR3-CONH2
请回答:
 外还有。
外还有。①只含有一个环的芳香族化合物
②核磁共振氢谱显示共有3组峰,强度比为2:2:3
③分子中不含有亚硝基(-N=O)和酯基