选项 | 实验目的 | 实验方案 |
A | 证明浓度对平衡FeCl3+3KSCN | 向FeCl3和KSCN的混合溶液中,加入少量的KCl固体 |
B | 氯气与水的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和KI溶液 |
C | KI3溶液中存在平衡: | 向盛有KI3溶液(显黄色)的①、②两支试管中分别滴加淀粉溶液、AgNO3溶液 |
D | 证明HClO的酸性比CH3COOH弱 | 室温下,用pH试纸分别测定0.1mol·L-1的NaClO溶液和0.1mol·L-1的CH3COONa溶液的pH |
弱电解质 | HCN | H2S | H2CO3 | HClO | CH3COOH |
电离平衡常数(25℃) | 6.2×10-10 | K1=1.1×10-7 K2=1.3×10-13 | K1=4.5×10-7 K2=4.7×10-11 | 4.0×10-8 | 1.75×10-5 |
①将pH=10的NaOH溶液与pH=12的NaOH溶液等体积混合后的pH接近于11.7(已知lg2=0.3);
②pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4;
③向pH=m的盐酸中加入pH=n的氢氧化钠溶液,恰好完全反应时,测得盐酸与氢氧化钠溶液的体积比为10:1,则m+n=13;
④若NaHA的溶液呈酸性,可以推测H2A为强酸;
⑤pH=7.0的NaClO和HCO(Ka=4.0×10-8)的混合溶液中,c(HClO)>c(ClO-)=(Na+);
⑥pH=9的CH3COONa溶液与pH=9的NaOH溶液,水的电离程度相同;
⑦等物质的量浓度的四种溶液a.NH3·H2O、b.NH4HSO4、c.(NH4)2CO3、d.NH4Cl,其中c(NH)的关系为b>c>d>a
①上述滴定操作用到的仪器有(填标号,下同)。

②该盐酸浓度为mol·L-1。
③该实验到达滴定终点时的现象是。
④下列关于滴定的操作及分析,正确的是。
A.碱式滴定管量取NaOH溶液时,未进行润洗,测量结果将偏高
B.滴定时应一直观察滴定管中溶液体积的变化
C.终点读数时如果俯视测量结果将偏高
D.平行滴定时,须重新装液并调节液面至“0”刻度
序号 | 反应试剂 | 体系温度/℃ | ||
反应前 | 反应后 | |||
i | 0.2mol·L-1CuSO4溶液100mL | 1.20g铁粉 | a | b |
ii | 0.56g铁粉 | a | c | |
①温度:bc(填“>”“<”或“=”)。
②△H=kJ·mol-1(选择表中一组数据计算)。
第1步:SO2(g)+V2O5(s)SO3(g)+V2O4(s) △H=bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g)2VOSO4(s) △H=ckJ·mol-1
第3步:_______。
第3步热化学方程式(△H的值用a、b、c的代数式表示)。
①CO2(g)+4H2CH4(g)+2H2O(g) △H1(298K)
②CO2(g)+H2(g)CO(g)+H2O(g) △H2(298K)
③2CO(g)+2H2(g)CO2(g)+CH4(g) △H3(298K)
在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓。
物质 | H2(g) | O2(g) | CO(g) | CO2(g) | H2O(g) | CH4(g) |
标准摩尔生成焓(kJ·mol-1) | 0 | 0 | -110.5 | -393.5 | -241.8 | -74.81 |
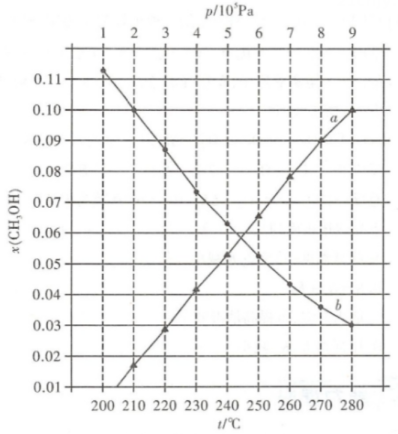
①当CO的平衡转化率为时,反应条件可能是。
②甲烷三重整制氢工业一般将反应温度设置为750℃~920℃,将反应压力设置为2~3MPa并向转化炉内通入空气或氧气,通入空气或氧气的目的是。