实验序号 | 待测液体积/mL |
| |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.00 | 23.13 |
2 | 20.00 | 1.68 | 26.18 |
3 | 20.00 | 0.22 | 23.31 |
4 | 20.00 | 0.70 | 23.78 |

①写出的电子式:。
②在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率 。
③写出该反应的平衡常数表达式:K=
④一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是。
A.
B. 容器内压强保持不变
C. 混合气体密度保持不变
D.

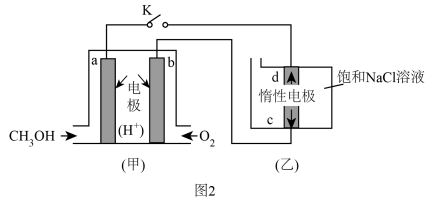
放电过程中需补充的物质A为(填化学式)。
化学式 | |||||
电离平衡常数K |
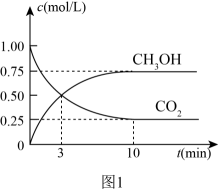
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
III.CO(g)+2H2(g)CH3OH(g),ΔH3=-90.6kJ·mol-1
回答下列问题: