选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 将Na加入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
B | 向H2SO4溶液中加入NaOH溶液至中性:H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-=H2O |
C | Na2O2与CO2反应:2Na2O2+2CO2=2Na2CO3+O2 | Na2O2与SO2反应:2Na2O2+2SO2=2Na2SO3+O2 |
D | 向NaOH溶液中通入过量CO2:CO2+OH-= | 向Ca(OH)2溶液中通入过量CO2:CO2+OH-= |
①Na2CO3·10H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤熔融NaHSO4 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧盐酸 ⑨CH3COOH ⑩Al2(SO4)3固体
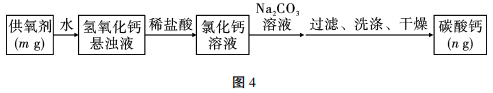

实验甲:甲同学用强光照射其中一个试管中的氯水,同时使用数据采集器采集数据如图6:
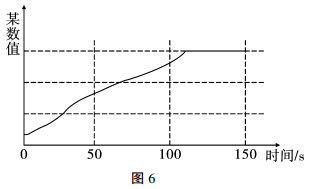
甲同学采集的数据是 (填序号)。
a.氯水的pH随时间的变化
b.溶液中氯离子浓度随时间的变化
c.液面上方氧气体积分数随时间的变化
实验乙:乙同学在另一试管的氯水中加入碳酸氢钠粉末,有无色气泡产生,乙指出氯气与水反应的产物具有酸性,甲同学认为不合理,原因是。