
已知:①键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。
②几种共价键的键能如下:
| 化学键 | C-H | Cl-Cl | C-Cl |
| 键能/kJ·mol-1 | 413 | 243 | 339 |
下列叙述正确的是( )
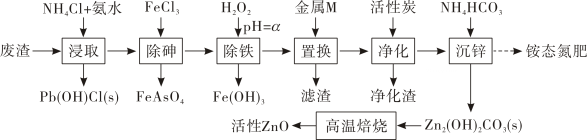
已知几种金属离子生成氢氧化物的pH如下表:
|
金属离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe3+ |
1.5 |
3.7 |
|
Zn2+ |
7.9 |
10.0 |
|
Fe2+ |
6.3 |
9.7 |
|
Cu2+ |
7.4 |
9.4 |
回答下列问题:
 。FeAsO4中铁的化合价为。
。FeAsO4中铁的化合价为。
A.氧化性 B.还原性 C.吸附性
②“沉锌”的滤液采用、,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
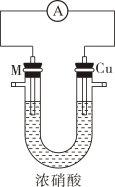
实验(一)M与浓硝酸反应。
取金属M片和铜片在浓硝酸中构成原电池,如图所示。
| 步骤 | 操作及现象 | 记录 |
| ① | 安装如图装置,加入试剂进行反应,电流表指针偏转 | 电流强度(1)为a(a>0) |
| ② | 随着反应进行,电流表指针偏转角度减小 | t1s时电流强度(I)为0 |
| ③ | 电流表指针向反方向偏转 | 电流强度(I)为b |

| 实验 | 操作 | 现象 |
| i | 向甲中滴加NH4SCN溶液 | 无明显现象 |
| ii | 向乙中滴加K3【Fe(CN)6】溶液 | 产生蓝色沉淀 |
已知亚铁离子遇K3【Fe(CN)6】溶液会产生蓝色沉淀,则下列关于铁极表面的物质的推断合理的是______________(填字母)。
已知:(棕色)。

实验发现,装置B中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置A中溶液,加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。
根据装置D、E现象可知,装置A中还原产物有(填化学式),产生该气体的原因是。
实验 | c(NO)/mol.L-1 | c(Br2)/mol. L-1 | c(NOBr)/mol.L-1 | 反应速率 |
I | 0.1 | 0.1 | 0.1 | v |
II | 0.2 | 0.1 | 0.1 | 4v |
Ⅲ | 0.2 | 0.2 | 0.1 | 8v |
IV | 0.4 | 0.2 | 0.2 | 16v |
①反应级数a为。
②其他条件相同,升高温度,k(填“增大”“减小”或“不变”)。

①属于绝热恒容容器的是(填“甲”或“乙”),中反应物总能量(填“高于”或“低于”)产物总能量。气体总物质的量:n(a)n(b)(填“>”“<”或“=”)。
②a点NO的转化率为。